ترمیم DNA چیه؟
می خوام بدونم منظور از ترمیم dna چیه و اینکه آیا میشه مشکلات ژنتیکی رو به این روش برطرف کرد

2 جواب
انواع آسیب های دنا بر اساس منشا
آسیب DNA را میتوان بر اساس منشا آنها به دو دسته اصلی طبقهبندی کرد:
عوامل درونی (Endogenous)
هربار که یک سلول انسانی، تکثیر میشود، حدود 3×1093×109 باز، با کارایی بسیار بالا، توسط آنزیم DNA پلیمراز، کپیبرداری خواهند شد. در این میان، برخی عوامل داخلی، باعث درج بازهای اشتباهی در رشته DNA میشوند. برخی از این عوامل، عبارتند از:
- اکسیداسیون بازها
- آلکیلاسیون بازها
- هیدرولیز بازها
- عدم تطابق بازها
بیشتر آسیب درونی DNA، ناشی از درگیری DNA در واکنشهای هیدرولیتیک و اکسایشی با آب و گونههای اکسیژن فعال (ROS) است که به طور طبیعی در سلولها وجود دارند. چنین واکنشهای ذاتی DNA با مولکولهای اطراف آن، باعث توسعه بیماریهای ارثی و سرطانهای تکگیر میشود.

عوامل بیرونی (Exogenous)
از طرف دیگر آسیب بیرونی DNA هنگامی رخ میدهد که عوامل محیطی، فیزیکی و شیمیایی به DNA آسیب میرسانند. به عنوان مثال، میتوان به اشعه ماورا بنفش و پرتوهای یونیزان، عوامل آلکیله کننده و عوامل پیوند عرضی اشاره کرد.
مهمترین آسیبهای ناشی از عوامل بیرونی، عبارتند از:
- نور UV-B، که باعث ایجاد پیوندهای عرضی بین سیتوزینها و تیمینهای مجاور و در نتیجه، ایجاد دیمرهای پیریمیدین میشود. به این فرایند، آسیب مستقیم DNA میگویند.
- نور UV-A بیشتر رادیکالهای آزاد ایجاد میکند. آسیب ناشی از رادیکالهای آزاد را آسیب غیر مستقیم DNA مینامند.
- تشعشعات یونیزه کننده، مانند پرتوهای مورد استفاده در عکسبرداری دندان، یا اشعههای کیهانی، باعث شکسته شدن رشتههای DNA میشود. تابش پرتو یونیزان سطح متوسط، ممکن است باعث آسیب جبران ناپذیر DNA شود که به نوبه خود، پیری و سرطان قبل از بلوغ را در پی دارد.
- تخریب حرارتی، در دمای بالا باعث افزایش دپورینه شدن DNA میشود. این فرایند، به معنی از بین رفتن بازهای پورین و حذف آنها از اسکلت DNA است. تخریب حرارتی، موجب ایجاد شکستگیهای تکرشتهای میشود.
- مواد شیمیایی صنعتی مانند وینیل کلراید و پراکسید هیدروژن و مواد شیمیایی محیطی مانند هیدروکربنهای آروماتیک چند حلقهای موجود در دود، دوده و قیر، تنوع عظیمی از ترکیبات جهشیافته دنا را ایجاد میکنند.
انواع آسیب های دنا بر اساس مکانیسم اثر
همانطور که گفتیم موجودات زنده به طور دائم در معرض عوامل درونی و بیرونی هستند که به DNA آسیب میرسانند. در صورت عدم ترمیم، چنین آسیبهایی میتواند منجر به جهش، بیماری و مرگ سلول شود. پاسخهای سلولی به آسیب DNA شامل فرایندهایی است که با عواقب آن مقابله میکنند.
به عنوان مثال، تحمل و آپوپتوز، دو نمونه از چنین پاسخهایی به شمار میروند. همچنین ترمیم مستقیم آسیب توسط مکانیسمهای ترمیم DNA، ساز و کار دفاعی دیگری است که البته ممکن است به فعالسازی مسیرهای «ایست-بازرسی» نیاز داشته باشد. عوامل آسیبرسان، به شکلهای مختلفی به DNA صدمه میزنند که مثالهایی از آن، عبارتند از:
- تغییر در نوکلئوتیدها
- شکستگی رشتهها
- اتصالات عرضی
- عدم تطابق
برای همانندسازی موفقیت آمیز DNA باید دو نوکلئوتید حاوی باز پورین، یعنی آدنین (A) و گوانین (G) با مکملهای پیریمیدینی خود، یعنی تیمین (T) و سیتوزین (C) جفت شوند. با این وجود، انواع مختلف آسیبها میتوانند از جفت شدن درست بازها جلوگیری کنند. مواردی از این آسیبها عبارتند از:
- جهشهای خود به خودی
- خطاهای همانندسازی
- تغییرات شیمیایی
جهشهای خود به خودی، زمانی اتفاق میافتند که بازهای DNA با محیط خود واکنش نشان دهند، مانند زمانی که آب، یک باز را هیدرولیز میکند و ساختار آن را تغییر میدهد و باعث جفت شدن آن با یک باز نادرست میشود.
خطاهای همانندسازی، هنگامی که ماشین تکثیر DNA، سنتز خود را «تصحیح» (Proofread) میکند، به حداقل میرسند، اما گاهی اوقات، جفت بازهای ناسازگار، از این تصحیح فرار میکنند.
عوامل شیمیایی نیز، با ایجاد تغییراتی در بازها، در تکثیر DNA تداخل ایجاد میکنند. به عنوان مثال، نیتروزامینها که در محصولاتی مانند آبجو و انواع ترشیها وجود دارند، میتوانند باعث آلکیلاسیون DNA (افزودن یک گروه آلکیل) شوند. عوامل اکسید کننده و تشعشعات یونیزان، رادیکالهای آزاد در سلول ایجاد میکنند که بازها، به ویژه گوانین را اکسید میکنند.

پرتو فرابنفش (UV) میتواند منجر به تولید رادیکالهای آزاد مخرب شود و با اتصال پیریمیدینهای مجاور، در یک رشته از دو رشته دنا، دیمرهای پیریمیدین ایجاد کند. تشکیل این دیمرها، مانع از تکثیر DNA خواهد شد.
تابش پرتوهای یونیزه کننده و استفاده از برخی داروهای خاص، مانند ماده شیمیایی «بلئومایسین» (Bleomycin)، نیز میتوانند با ایجاد شکافهای دو رشتهای در DNA، از همانندسازی آن جلوگیری کنند. این عوامل، همچنین میتوانند موجب ایجاد شکستگیهای تک رشتهای در ساختار دنا شوند. غلبه بر این شکل از آسیب، اغلب برای سلولها آسانتر است. آنالوگهای بازها و عوامل درجشونده در DNA نیز میتوانند باعث درج و حذفهای غیرطبیعی در توالی شوند.
هریک از عومال جهشزایی که به آنها اشاره کردیم، در صورت عدم ترمیم، موجب ایجاد یک جهش ژنتیکی خواهند شد. این جهشها به معنی تغییر در یک یا چند نوکلئوتید، در رشته DNA هستند و با تکنیکهای مختلفی شناسایی یمیشوند. یکی از این روشها، مقایسه توالی ژن فرد مشکوک، با توالی همان ژن در فرد سالم است، که به کمک نرمافزارهای ویژه این کار، صورت میگیرد.
یکی از بهترین نرم افزارها در حوزه مقایسه و آنالیز توالیها، CLC است، که فرادرس، مجموعهای از نکات آموزشی مرتبط با آن را در قالب یک فیلم آموزشی، منتشر کرده است و میتوانید آن را از طریق لینک زیر، مشاهده کنید.
مسیرهای ترمیم دنا
سه نوع ساز و کار اصلی برای ترمیم دنا وجود دارد:
- ترمیم برگشت مستقیم آسیب (Direct Reversal of the Damage)
- ترمیم برش (Excision Repair)
- ترمیم پس از همانندسازی (Postreplication Repair)
هریک از این ساز و کارها از مسیرهای مختلفی برای ترمیم DNA استفاده میکنند. هر مسیر ترمیم، برای انواع خاصی از آسیب، طراحی شده است و نوع معینی از آسیب میتواند توسط چندین مسیر ترمیمی، مورد هدف قرار گیرد. مسیرهای اصلی ترمیم DNA عبارتند از:
- ترمیم عدم تطابق (MMR)
- ترمیم برش نوکلئوتید (NER)
- ترمیم برش باز آلی (BER)
- ترمیم نوترکیبی همولوگ (HR)
- پیوند انتهایی غیر همولوگ (NHEJ)
سه مکانیسم اول، برای ترمیم آسیبهای تکرشتهای به کار گرفته میشوند. اما اگر هر دو رشته دنا، دچار آسیب شده باشند، سلول، از یکی از دو مکانیسم HR یا NHEJ برای ترمیم ناحیه صدمه دیده، کمک خواهد گرفت.
ترمیم برگشت مستقیم، در مورد هر جهش، به صورت اختصاصی عمل میکند. به عنوان مثال، در فرایندی به نام «بازفعال سازی نوری» (Photoreactivation)، بازهای پیریمیدین متصل شده توسط پرتو فرابنفش، در حضور نور مرئی، توسط آنزیم DNA فوتولیاز، دوباره از هم جدا میشوند. این آنزیم، با تابش نور، فعال میشود.
برای برگشت مستقیم جهشهای ناشی از آلکیلاسیون، آنزیم DNA متیل ترانسفراز یا DNA گلیکوزیلاز، گروه آلکیل را شناسایی و حذف میکنند. ترمیم برش، میتواند اختصاصی یا غیر اختصاصی باشد.
در «ترمیم برش باز» (Base Excision Repair | BER)، گلیکوزیلازهای DNA به طور اختصاصی، باز نامناسب را شناسایی و آن را از رشته جدا میکنند. در «ترمیم برش نوکلئوتید» (Nucleotide Excision Repair | NER)، ماشین تعمیر، مجموعه وسیعی از بههمریختگیهای ناشی از بازهای ناسازگار را در مارپیچ دوتایی DNA تشخیص میدهد. در این شکل از ترمیم، کل منطقه آسیب دیده، از مولکول DNA خارج میشود.
ترمیم پس از تکثیر، در پایین دست ضایعه رخ میدهد، زیرا تکثیر در محل واقعی آسیب، مسدود و متوقف شده است. همانطور که میدانید در فرایند همانندسازی دنا، بخشهای کوتاهی از DNA به نام قطعات اوکازاکی سنتز و سپس، هر قطعه، توسط آنزیم لیگاز، به قطعه قبلی، متصل میشود.
در این نوع ترمیم نیز، با ساز و کاری مشابه، قطعاتی از دنا ساخته میشوند و شکاف باقیمانده در محل آسیب، از طریق فرایندی به نام «ترمیم نوترکیبی» (Recombination Repair) پر خواهد شد. این نوع ترمیم، از توالی کروموزوم خواهری سالم، برای ترمیم DNA آسیب دیده استفاده میکند. روش دیگر، «ترمیم مستعد خطا» (Error Prone Repair) است که طی آن، از رشته آسیب دیده، به عنوان توالی الگو استفاده میشود. ترمیم مستعد خطا، معمولاً نادرست است و شانس جهشهای مختلف را افزایش میدهد.
ترمیم عدم تطابق (MMR)
«ترمیم عدم تطابق» (Mismatch Repair) ، سیستمی برای شناسایی و ترمیم اشتباهات درج، حذف و ورود باز اضافی اشتباه در رشته دنا است که ممکن است در طی همانندسازی و نوترکیبی DNA ایجاد شود. این سیستم ترمیمی، همچنین، برخی از اشکال آسیب DNA را تعمیر میکند.
ترمیم DNA به روش MMR
تعمیر عدم تطابق، به صورت «اختصاصی رشته» (Strand-Specific) عمل میکند. در طول سنتز DNA، رشته تازه ساخته شده (رشته دختری) معمولاً شامل خطاهایی است. به منظور شروع تعمیر، ماشین تعمیر عدم تطابق، این رشته تازه سنتز شده را از الگو (رشته والدی) متمایز میکند.
در باکتریهای گرم منفی، هِمی متیلاسیون موقتی مولکول دنا، دو رشته را از هم متمایز میکند. به این ترتیب که در مدت کوتاهی از چرخه سلول، رشته والدی به صورت متیله و رشته دختری به صورت غیر متیله دیده میشوند. با این حال، در سایر پروکاریوتها و یوکاریوتها، مکانیسم دقیق تشخیص رشتهها، هنوز روشن نیست.
ترمیم برش نوکلئوتید (NER)
ترمیم برش نوکلئوتید، به ویژه در ترمیم آسیب ناشی از نور فرابنفش (UV) از اهمیت فراوانی برخوردار است. آسیب DNA در اثر پرتو فرابنفش، منجر به ایجاد ترکیبات جدیدی در ساختار DNA میشود، که در مجموع، به آنها «ترکیبات حجیم دارای اضافه بار» (Bulky Adducts) گفته میشود. این ترکیبات اضافی، بیشتر، شامل دیمرهای تیمین و محصولات نوری 6،4 هستند و باعث ایجاد به همریختگی در ساختار مارپیچ رشته دنا میشوند.
ترمیم DNA به روش NER
تشخیص چنین آسیبهایی در دنا، منجر به حذف یک قطعه DNA کوتاه تک رشتهای میشود که حاوی ضایعه است. DNA تک رشتهای آسیب ندیده، در جای خود باقی میماند و DNA پلیمراز، از آن به عنوان الگویی برای سنتز یک توالی مکمل کوتاه استفاده میکند. پس از ساخت این قطعه کوتاه، آنزیم لیگاز، انتهای آن را به قطعه بعدی، متصل میکند و مولکول دو رشتهای DNA دوباره شکل میگیرد.
ترمیم برش باز آلی (BER)
وظیفه اصلی این سیستم ترمیمی این است که ضایعات بازی کوچک را از روی ژنوم حذف کند. این آسیبها، اگرچه ساختار مارپیچی دنا را تحت تاثیر قرار نمیدهند، اما به نوبه خود، میتوانند اثرات مخربی بر فعالیتهای سلول داشته باشند.
همانطور که از نام آن برمیآید، سیستم BER برای از حذف بازهای آسیب دیده، مهم است که عدم ترمیم آنها موجب جفت شدنهای اشتباهی و سرانجام، ایجاد و حفظ جهش در ژنوم یا منجر به شکستگی DNA در هنگام تکثیر میشود. BER توسط گلیکوزیلازهای DNA آغاز میشود، که بازهای خاص آسیب دیده یا نامناسب را شناسایی میکنند و از بین میبرند. در حالی که اسکلت قند و فسفات نوکلئوتیدها، در جای خود، باقی میماند.
سیستم ترمیم با استفاده از برش باز آلی
در نتیجه حذف باز از نوکلئوتید آسیب دیده، یک «جایگاه فاقد پورین / پیریمیدین»، (apurinic/apyrimidinic site) ایجاد میشود که آن را به اختصار AP مینامیم. در گام بعد، این جایگاههای AP توسط یک اندونوکلئاز AP شکاف میخورند. شکست تک رشتهای حاصل، با یکی از دو مکانیسم زیر، پر میشود.
- «وصله کوتاه» (Short-Patch): جایگزینی یک نوکلئوتید با نوکلئوتید دیگر
- «وصله بلند» (Long-Patch): جایگزینی 2 تا 10 نوکلئوتید جدید، به جای نوکلئوتیدهای محدوده آسیب دیده
ترمیم نوترکیبی همولوگ (HR)
نوترکیبی همولوگ، شکافهای دو رشتهای DNA ناشی از تشعشعات یونیزان یا مواد شیمیایی آسیب رسان به DNA را ترمیم میکند. در صورت عدم ترمیم، این شکستگیهای دو رشتهای میتوانند باعث بازآرایی منطقه بزرگی از کروموزوم شوند، که به نوبه خود، عوارض جدی، مثل سرطان را در پی خواهد داشت. ترمیم HR رایجترین نوع از «ترمیم وابسته به همولوژی» (Homology-Directed Repair) است که به اختصار، HDR نامیده میشود.

ترمیم DNA با استفاده از همولوژی
مکانیسم HDR تنها زمانی توسط سلول استفاده میشود که یک قطعه همولوگ DNA آسیب دیده، در هسته وجود داشته باشد. این ویژگی، بیشتر در فازهای G2 و S چرخه سلولی دیده میشود. وقتی DNA همولوگ وجود ندارد ، به جای آن فرآیند دیگری به نام اتصال به انتهای غیرهمولوگ (non-homologous end joining | NHEJ) اتفاق میافتد که در ادامه به آن میپردازیم.
پیوند انتهایی غیر همولوگ (NHEJ)
این مکانیسم ترمیم نیز برای تعمیر شکافهای دو رشتهای دنا (Double Strand Break | DBS) طراحی شده است. در عنوان این مکانیسم، از اصطلاح «غیر همولوگ» استفاده شده است و گویای آن است که انتهای شکست در هر رشته، مستقیماً و بدون نیاز به الگوی همولوگ، به قطعه بعدی متصل میشود؛ بر خلاف ترمیم HDR، که برای هدایت ترمیم، به یک توالی همولوگ، نیاز دارد.
NHEJ به طور معمول، توسط توالیهای DNA همولوگ کوتاه، به نام «ریزهمولوژی» (Microhomologies) هدایت میشود. این ریزهمولوژیها اغلب، به صورت یک دنباله تک رشتهای، در انتهای شکافهای دو رشته وجود دارند. هنگامی که برآمدگیهای دو رشته دنا، کاملاً با هم مکمل باشند، NHEJ معمولاً شکست را با دقت ترمیم میکند.
البته ترمیم نادرست نیز ممکن است رخ دهد، که منجر به از دست دادن نوکلئوتیدها خواهد شد. اما این اتفاق، به ویژه زمانی دیده میشود که دو دنباله تک رشتهای، در تمام طول خود، مکمل هم نباشند. NHEJ نامناسب میتواند منجر به جابجایی و همجوشی تلومر شود، که از مشخصات اصلی سلولهای توموری است.
غالباً هنگامی که DNA آسیب میبیند، سلول به جای انتظار برای ترمیم، ترجیح میدهد با وجود ضایعه، به همانندسازی و تکثیر، ادامه دهد. اگرچه این امر، ممکن است به جهش منجر شود، اما بر متوقف شدن در مرحله همانندسازی، ارجح است؛ چرا که این توقف، موجب مرگ سلول خواهد شد.

بیماری گزرودرما پیگمنتوزوم، نوعی اختلال ژنتیکی است که در اثر اختلال در عملکرد سلول، برای ترمیم آسیبهای ناشی از پرتو فرابنفش ایجاد میشود. علائم این بیماری، شامل آفتاب سوختگی شدید، تنها پس از چند دقیقه حضور در معرض آفتاب، کک و مک در بخشهای آفتاب خورده، خشکی پوست و تغییر در رنگدانههای پوست است.
اختلال در ترمیم دنا
ترمیم درست DNA از اهمیت فراوانی برای بقای جانداران برخوردار است و خطای این فرایند، موجب ایجاد انواع بیماریها میشود. به عنوان مثال، اکسیداسیون گوانین، توسط رادیکالهای آزاد، منجر به ایجاد جفت باز اشتباهی G-T میشود که یکی از رایجترین جهشها در سرطان است.
سرطان کولورکتال غیرپولیپوز وراثتی، در اثر جهش در پروتئینهای MSH2 و MLH1 ایجاد میشود، که عدم تطابقها را هنگام تکثیر، ترمیم میکند. بیماری زرودرما پیگمنتوزوم (Xeroderma pigmentosum | XP) بیماری دیگری است که در نتیجه عدم موفقیت در ترمیم DNA ایجاد میشود.
بیماران مبتلا به XP، بسیار حساس به نور هستند، پیری زودرس پوست را نشان میدهند و مستعد ابتلا به تومورهای بدخیم پوست هستند. زیرا پروتئینهای XP، که بسیاری از آنها در ترمیم برش نوکلئوتید (NER) دخالت دارند، قادر به ادامه فعالیت نیستند.
https://blog.faradars.org/%D8%AA%D8%B1%D9%85%DB%8C%D9%85-%D8%AF%D9%86%D8%A7/
ترمیم دنا (DNA Repair) به ساز و کارهای مختلفی گفته میشود که سلول به وسیله آنها یکپارچگی کد ژنتیکی خود را حفظ میکند. ترمیم DNA بقای یک گونه را تضمین میکند، زیرا DNA والدین، تقریبا، بدون تغییر، به فرزندان به ارث میرسد. این فرایند، همچنین برای حفظ سلامتی خود فرد نیز، مهم و کلیدی است. جهش در کد ژنتیکی، میتواند منجر به سرطان و سایر بیماریهای ژنتیکی شود.
فهرست مطالب این نوشته پنهان کردن
1. انواع آسیب های دنا بر اساس منشا
2. انواع آسیب های دنا بر اساس مکانیسم اثر
3.2. ترمیم برش نوکلئوتید (NER)
3.4. ترمیم نوترکیبی همولوگ (HR)
3.5. پیوند انتهایی غیر همولوگ (NHEJ)
5.فیلم آموزش زیست شناسی سلولی و مولکولی – مبانی و مفاهیم مقدماتی
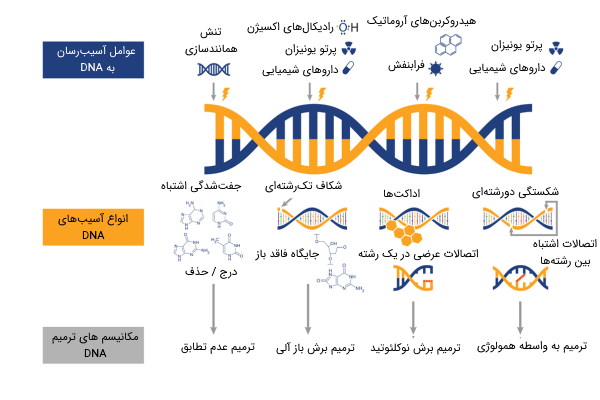
در این نوشتار، به انواع آسیبهای تهدیدکننده DNA میپردازیم و ساز و کارهای ترمیم دنا را معرفی میکنیم. انواع روشهای برش باز آلی، برش نوکلئوتید، شناسایی عدم تطابق و همچنین، روشهای مبتنی بر نوترکیبی و اتصال غیر همولوگ، از جمله راهکارهای سلول، برای ترمیم DNA آسیب دیده به شمار میروند.
انواع آسیب های دنا بر اساس منشا
آسیب DNA را میتوان بر اساس منشا آنها به دو دسته اصلی طبقهبندی کرد:
عوامل درونی (Endogenous)
هربار که یک سلول انسانی، تکثیر میشود، حدود 3×1093×109 باز، با کارایی بسیار بالا، توسط آنزیم DNA پلیمراز، کپیبرداری خواهند شد. در این میان، برخی عوامل داخلی، باعث درج بازهای اشتباهی در رشته DNA میشوند. برخی از این عوامل، عبارتند از:
- اکسیداسیون بازها
- آلکیلاسیون بازها
- هیدرولیز بازها
- عدم تطابق بازها
بیشتر آسیب درونی DNA، ناشی از درگیری DNA در واکنشهای هیدرولیتیک و اکسایشی با آب و گونههای اکسیژن فعال (ROS) است که به طور طبیعی در سلولها وجود دارند. چنین واکنشهای ذاتی DNA با مولکولهای اطراف آن، باعث توسعه بیماریهای ارثی و سرطانهای تکگیر میشود.

عوامل بیرونی (Exogenous)
از طرف دیگر آسیب بیرونی DNA هنگامی رخ میدهد که عوامل محیطی، فیزیکی و شیمیایی به DNA آسیب میرسانند. به عنوان مثال، میتوان به اشعه ماورا بنفش و پرتوهای یونیزان، عوامل آلکیله کننده و عوامل پیوند عرضی اشاره کرد.
مهمترین آسیبهای ناشی از عوامل بیرونی، عبارتند از:
- نور UV-B، که باعث ایجاد پیوندهای عرضی بین سیتوزینها و تیمینهای مجاور و در نتیجه، ایجاد دیمرهای پیریمیدین میشود. به این فرایند، آسیب مستقیم DNA میگویند.
- نور UV-A بیشتر رادیکالهای آزاد ایجاد میکند. آسیب ناشی از رادیکالهای آزاد را آسیب غیر مستقیم DNA مینامند.
- تشعشعات یونیزه کننده، مانند پرتوهای مورد استفاده در عکسبرداری دندان، یا اشعههای کیهانی، باعث شکسته شدن رشتههای DNA میشود. تابش پرتو یونیزان سطح متوسط، ممکن است باعث آسیب جبران ناپذیر DNA شود که به نوبه خود، پیری و سرطان قبل از بلوغ را در پی دارد.
- تخریب حرارتی، در دمای بالا باعث افزایش دپورینه شدن DNA میشود. این فرایند، به معنی از بین رفتن بازهای پورین و حذف آنها از اسکلت DNA است. تخریب حرارتی، موجب ایجاد شکستگیهای تکرشتهای میشود.
- مواد شیمیایی صنعتی مانند وینیل کلراید و پراکسید هیدروژن و مواد شیمیایی محیطی مانند هیدروکربنهای آروماتیک چند حلقهای موجود در دود، دوده و قیر، تنوع عظیمی از ترکیبات جهشیافته دنا را ایجاد میکنند.
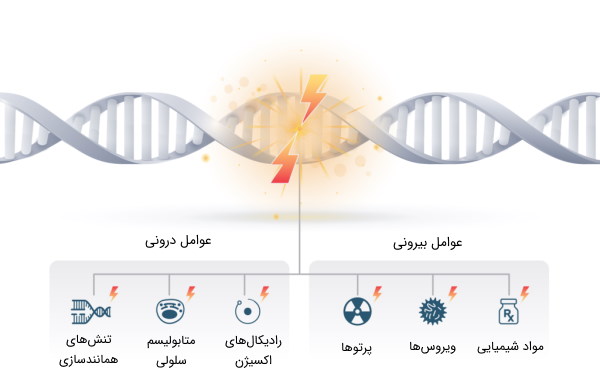
عوامل آسیب رسان به DNA
انواع آسیب های دنا بر اساس مکانیسم اثر
همانطور که گفتیم موجودات زنده به طور دائم در معرض عوامل درونی و بیرونی هستند که به DNA آسیب میرسانند. در صورت عدم ترمیم، چنین آسیبهایی میتواند منجر به جهش، بیماری و مرگ سلول شود. پاسخهای سلولی به آسیب DNA شامل فرایندهایی است که با عواقب آن مقابله میکنند.
به عنوان مثال، تحمل و آپوپتوز، دو نمونه از چنین پاسخهایی به شمار میروند. همچنین ترمیم مستقیم آسیب توسط مکانیسمهای ترمیم DNA، ساز و کار دفاعی دیگری است که البته ممکن است به فعالسازی مسیرهای «ایست-بازرسی» نیاز داشته باشد. عوامل آسیبرسان، به شکلهای مختلفی به DNA صدمه میزنند که مثالهایی از آن، عبارتند از:
- تغییر در نوکلئوتیدها
- شکستگی رشتهها
- اتصالات عرضی
- عدم تطابق
برای همانندسازی موفقیت آمیز DNA باید دو نوکلئوتید حاوی باز پورین، یعنی آدنین (A) و گوانین (G) با مکملهای پیریمیدینی خود، یعنی تیمین (T) و سیتوزین (C) جفت شوند. با این وجود، انواع مختلف آسیبها میتوانند از جفت شدن درست بازها جلوگیری کنند. مواردی از این آسیبها عبارتند از:
- جهشهای خود به خودی
- خطاهای همانندسازی
- تغییرات شیمیایی
جهشهای خود به خودی، زمانی اتفاق میافتند که بازهای DNA با محیط خود واکنش نشان دهند، مانند زمانی که آب، یک باز را هیدرولیز میکند و ساختار آن را تغییر میدهد و باعث جفت شدن آن با یک باز نادرست میشود.
خطاهای همانندسازی، هنگامی که ماشین تکثیر DNA، سنتز خود را «تصحیح» (Proofread) میکند، به حداقل میرسند، اما گاهی اوقات، جفت بازهای ناسازگار، از این تصحیح فرار میکنند.
عوامل شیمیایی نیز، با ایجاد تغییراتی در بازها، در تکثیر DNA تداخل ایجاد میکنند. به عنوان مثال، نیتروزامینها که در محصولاتی مانند آبجو و انواع ترشیها وجود دارند، میتوانند باعث آلکیلاسیون DNA (افزودن یک گروه آلکیل) شوند. عوامل اکسید کننده و تشعشعات یونیزان، رادیکالهای آزاد در سلول ایجاد میکنند که بازها، به ویژه گوانین را اکسید میکنند.

پرتو فرابنفش (UV) میتواند منجر به تولید رادیکالهای آزاد مخرب شود و با اتصال پیریمیدینهای مجاور، در یک رشته از دو رشته دنا، دیمرهای پیریمیدین ایجاد کند. تشکیل این دیمرها، مانع از تکثیر DNA خواهد شد.
تابش پرتوهای یونیزه کننده و استفاده از برخی داروهای خاص، مانند ماده شیمیایی «بلئومایسین» (Bleomycin)، نیز میتوانند با ایجاد شکافهای دو رشتهای در DNA، از همانندسازی آن جلوگیری کنند. این عوامل، همچنین میتوانند موجب ایجاد شکستگیهای تک رشتهای در ساختار دنا شوند. غلبه بر این شکل از آسیب، اغلب برای سلولها آسانتر است. آنالوگهای بازها و عوامل درجشونده در DNA نیز میتوانند باعث درج و حذفهای غیرطبیعی در توالی شوند.
هریک از عومال جهشزایی که به آنها اشاره کردیم، در صورت عدم ترمیم، موجب ایجاد یک جهش ژنتیکی خواهند شد. این جهشها به معنی تغییر در یک یا چند نوکلئوتید، در رشته DNA هستند و با تکنیکهای مختلفی شناسایی یمیشوند. یکی از این روشها، مقایسه توالی ژن فرد مشکوک، با توالی همان ژن در فرد سالم است، که به کمک نرمافزارهای ویژه این کار، صورت میگیرد.
یکی از بهترین نرم افزارها در حوزه مقایسه و آنالیز توالیها، CLC است، که فرادرس، مجموعهای از نکات آموزشی مرتبط با آن را در قالب یک فیلم آموزشی، منتشر کرده است و میتوانید آن را از طریق لینک زیر، مشاهده کنید.
- برای مشاهده فیلم آموزش آنالیز توالی ژنها با نرم افزار CLC Main Workbench + اینجا کلیک کنید.
مسیرهای ترمیم دنا
سه نوع ساز و کار اصلی برای ترمیم دنا وجود دارد:
- ترمیم برگشت مستقیم آسیب (Direct Reversal of the Damage)
- ترمیم برش (Excision Repair)
- ترمیم پس از همانندسازی (Postreplication Repair)
هریک از این ساز و کارها از مسیرهای مختلفی برای ترمیم DNA استفاده میکنند. هر مسیر ترمیم، برای انواع خاصی از آسیب، طراحی شده است و نوع معینی از آسیب میتواند توسط چندین مسیر ترمیمی، مورد هدف قرار گیرد. مسیرهای اصلی ترمیم DNA عبارتند از:
- ترمیم عدم تطابق (MMR)
- ترمیم برش نوکلئوتید (NER)
- ترمیم برش باز آلی (BER)
- ترمیم نوترکیبی همولوگ (HR)
- پیوند انتهایی غیر همولوگ (NHEJ)
سه مکانیسم اول، برای ترمیم آسیبهای تکرشتهای به کار گرفته میشوند. اما اگر هر دو رشته دنا، دچار آسیب شده باشند، سلول، از یکی از دو مکانیسم HR یا NHEJ برای ترمیم ناحیه صدمه دیده، کمک خواهد گرفت.

ترمیم برگشت مستقیم، در مورد هر جهش، به صورت اختصاصی عمل میکند. به عنوان مثال، در فرایندی به نام «بازفعال سازی نوری» (Photoreactivation)، بازهای پیریمیدین متصل شده توسط پرتو فرابنفش، در حضور نور مرئی، توسط آنزیم DNA فوتولیاز، دوباره از هم جدا میشوند. این آنزیم، با تابش نور، فعال میشود.
برای برگشت مستقیم جهشهای ناشی از آلکیلاسیون، آنزیم DNA متیل ترانسفراز یا DNA گلیکوزیلاز، گروه آلکیل را شناسایی و حذف میکنند. ترمیم برش، میتواند اختصاصی یا غیر اختصاصی باشد.
در «ترمیم برش باز» (Base Excision Repair | BER)، گلیکوزیلازهای DNA به طور اختصاصی، باز نامناسب را شناسایی و آن را از رشته جدا میکنند. در «ترمیم برش نوکلئوتید» (Nucleotide Excision Repair | NER)، ماشین تعمیر، مجموعه وسیعی از بههمریختگیهای ناشی از بازهای ناسازگار را در مارپیچ دوتایی DNA تشخیص میدهد. در این شکل از ترمیم، کل منطقه آسیب دیده، از مولکول DNA خارج میشود.
ترمیم پس از تکثیر، در پایین دست ضایعه رخ میدهد، زیرا تکثیر در محل واقعی آسیب، مسدود و متوقف شده است. همانطور که میدانید در فرایند همانندسازی دنا، بخشهای کوتاهی از DNA به نام قطعات اوکازاکی سنتز و سپس، هر قطعه، توسط آنزیم لیگاز، به قطعه قبلی، متصل میشود.
در این نوع ترمیم نیز، با ساز و کاری مشابه، قطعاتی از دنا ساخته میشوند و شکاف باقیمانده در محل آسیب، از طریق فرایندی به نام «ترمیم نوترکیبی» (Recombination Repair) پر خواهد شد. این نوع ترمیم، از توالی کروموزوم خواهری سالم، برای ترمیم DNA آسیب دیده استفاده میکند. روش دیگر، «ترمیم مستعد خطا» (Error Prone Repair) است که طی آن، از رشته آسیب دیده، به عنوان توالی الگو استفاده میشود. ترمیم مستعد خطا، معمولاً نادرست است و شانس جهشهای مختلف را افزایش میدهد.
ترمیم عدم تطابق (MMR)
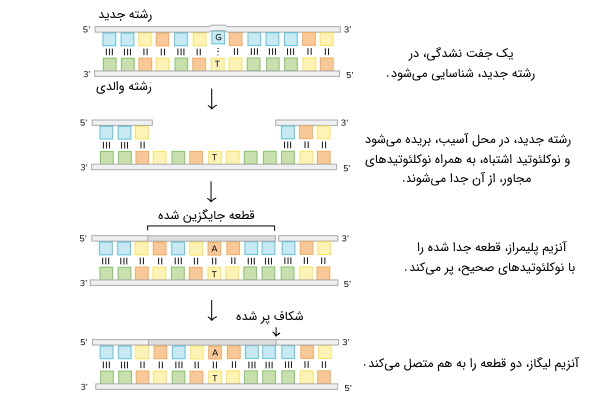
«ترمیم عدم تطابق» (Mismatch Repair) ، سیستمی برای شناسایی و ترمیم اشتباهات درج، حذف و ورود باز اضافی اشتباه در رشته دنا است که ممکن است در طی همانندسازی و نوترکیبی DNA ایجاد شود. این سیستم ترمیمی، همچنین، برخی از اشکال آسیب DNA را تعمیر میکند.

ترمیم DNA به روش MMR
تعمیر عدم تطابق، به صورت «اختصاصی رشته» (Strand-Specific) عمل میکند. در طول سنتز DNA، رشته تازه ساخته شده (رشته دختری) معمولاً شامل خطاهایی است. به منظور شروع تعمیر، ماشین تعمیر عدم تطابق، این رشته تازه سنتز شده را از الگو (رشته والدی) متمایز میکند.
در باکتریهای گرم منفی، هِمی متیلاسیون موقتی مولکول دنا، دو رشته را از هم متمایز میکند. به این ترتیب که در مدت کوتاهی از چرخه سلول، رشته والدی به صورت متیله و رشته دختری به صورت غیر متیله دیده میشوند. با این حال، در سایر پروکاریوتها و یوکاریوتها، مکانیسم دقیق تشخیص رشتهها، هنوز روشن نیست.
ترمیم برش نوکلئوتید (NER)
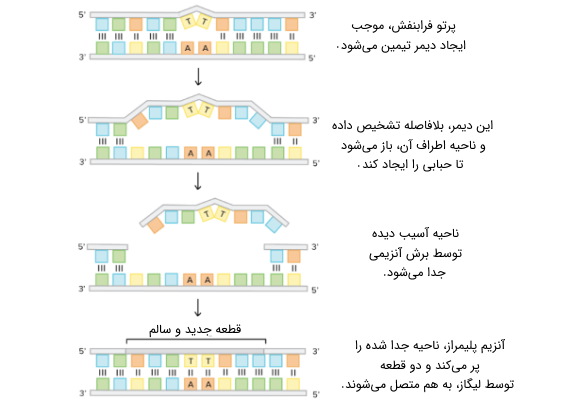
ترمیم برش نوکلئوتید، به ویژه در ترمیم آسیب ناشی از نور فرابنفش (UV) از اهمیت فراوانی برخوردار است. آسیب DNA در اثر پرتو فرابنفش، منجر به ایجاد ترکیبات جدیدی در ساختار DNA میشود، که در مجموع، به آنها «ترکیبات حجیم دارای اضافه بار» (Bulky Adducts) گفته میشود. این ترکیبات اضافی، بیشتر، شامل دیمرهای تیمین و محصولات نوری 6،4 هستند و باعث ایجاد به همریختگی در ساختار مارپیچ رشته دنا میشوند.

ترمیم DNA به روش NER
تشخیص چنین آسیبهایی در دنا، منجر به حذف یک قطعه DNA کوتاه تک رشتهای میشود که حاوی ضایعه است. DNA تک رشتهای آسیب ندیده، در جای خود باقی میماند و DNA پلیمراز، از آن به عنوان الگویی برای سنتز یک توالی مکمل کوتاه استفاده میکند. پس از ساخت این قطعه کوتاه، آنزیم لیگاز، انتهای آن را به قطعه بعدی، متصل میکند و مولکول دو رشتهای DNA دوباره شکل میگیرد.
ترمیم برش باز آلی (BER)
وظیفه اصلی این سیستم ترمیمی این است که ضایعات بازی کوچک را از روی ژنوم حذف کند. این آسیبها، اگرچه ساختار مارپیچی دنا را تحت تاثیر قرار نمیدهند، اما به نوبه خود، میتوانند اثرات مخربی بر فعالیتهای سلول داشته باشند.
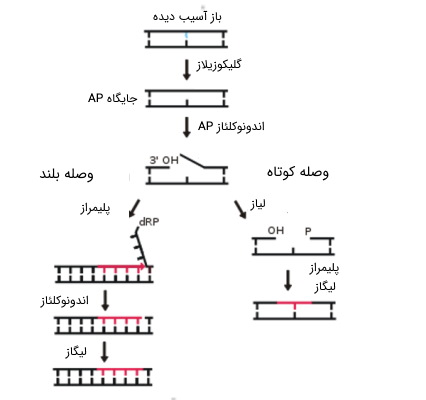
همانطور که از نام آن برمیآید، سیستم BER برای از حذف بازهای آسیب دیده، مهم است که عدم ترمیم آنها موجب جفت شدنهای اشتباهی و سرانجام، ایجاد و حفظ جهش در ژنوم یا منجر به شکستگی DNA در هنگام تکثیر میشود. BER توسط گلیکوزیلازهای DNA آغاز میشود، که بازهای خاص آسیب دیده یا نامناسب را شناسایی میکنند و از بین میبرند. در حالی که اسکلت قند و فسفات نوکلئوتیدها، در جای خود، باقی میماند.

سیستم ترمیم با استفاده از برش باز آلی
در نتیجه حذف باز از نوکلئوتید آسیب دیده، یک «جایگاه فاقد پورین / پیریمیدین»، (apurinic/apyrimidinic site) ایجاد میشود که آن را به اختصار AP مینامیم. در گام بعد، این جایگاههای AP توسط یک اندونوکلئاز AP شکاف میخورند. شکست تک رشتهای حاصل، با یکی از دو مکانیسم زیر، پر میشود.
- «وصله کوتاه» (Short-Patch): جایگزینی یک نوکلئوتید با نوکلئوتید دیگر
- «وصله بلند» (Long-Patch): جایگزینی 2 تا 10 نوکلئوتید جدید، به جای نوکلئوتیدهای محدوده آسیب دیده
ترمیم نوترکیبی همولوگ (HR)
نوترکیبی همولوگ، شکافهای دو رشتهای DNA ناشی از تشعشعات یونیزان یا مواد شیمیایی آسیب رسان به DNA را ترمیم میکند. در صورت عدم ترمیم، این شکستگیهای دو رشتهای میتوانند باعث بازآرایی منطقه بزرگی از کروموزوم شوند، که به نوبه خود، عوارض جدی، مثل سرطان را در پی خواهد داشت. ترمیم HR رایجترین نوع از «ترمیم وابسته به همولوژی» (Homology-Directed Repair) است که به اختصار، HDR نامیده میشود.

ترمیم DNA با استفاده از همولوژی
مکانیسم HDR تنها زمانی توسط سلول استفاده میشود که یک قطعه همولوگ DNA آسیب دیده، در هسته وجود داشته باشد. این ویژگی، بیشتر در فازهای G2 و S چرخه سلولی دیده میشود. وقتی DNA همولوگ وجود ندارد ، به جای آن فرآیند دیگری به نام اتصال به انتهای غیرهمولوگ (non-homologous end joining | NHEJ) اتفاق میافتد که در ادامه به آن میپردازیم.
پیوند انتهایی غیر همولوگ (NHEJ)
این مکانیسم ترمیم نیز برای تعمیر شکافهای دو رشتهای دنا (Double Strand Break | DBS) طراحی شده است. در عنوان این مکانیسم، از اصطلاح «غیر همولوگ» استفاده شده است و گویای آن است که انتهای شکست در هر رشته، مستقیماً و بدون نیاز به الگوی همولوگ، به قطعه بعدی متصل میشود؛ بر خلاف ترمیم HDR، که برای هدایت ترمیم، به یک توالی همولوگ، نیاز دارد.
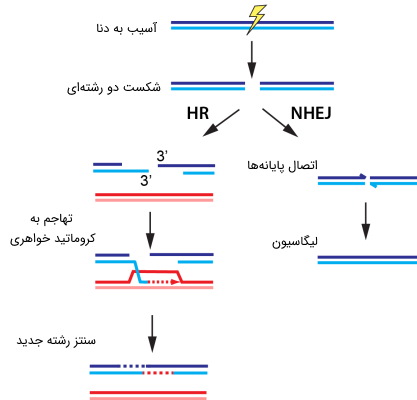
مقایسه سیستم ترمیم HR و NHEJ
NHEJ به طور معمول، توسط توالیهای DNA همولوگ کوتاه، به نام «ریزهمولوژی» (Microhomologies) هدایت میشود. این ریزهمولوژیها اغلب، به صورت یک دنباله تک رشتهای، در انتهای شکافهای دو رشته وجود دارند. هنگامی که برآمدگیهای دو رشته دنا، کاملاً با هم مکمل باشند، NHEJ معمولاً شکست را با دقت ترمیم میکند.
البته ترمیم نادرست نیز ممکن است رخ دهد، که منجر به از دست دادن نوکلئوتیدها خواهد شد. اما این اتفاق، به ویژه زمانی دیده میشود که دو دنباله تک رشتهای، در تمام طول خود، مکمل هم نباشند. NHEJ نامناسب میتواند منجر به جابجایی و همجوشی تلومر شود، که از مشخصات اصلی سلولهای توموری است.
غالباً هنگامی که DNA آسیب میبیند، سلول به جای انتظار برای ترمیم، ترجیح میدهد با وجود ضایعه، به همانندسازی و تکثیر، ادامه دهد. اگرچه این امر، ممکن است به جهش منجر شود، اما بر متوقف شدن در مرحله همانندسازی، ارجح است؛ چرا که این توقف، موجب مرگ سلول خواهد شد.

بیماری گزرودرما پیگمنتوزوم، نوعی اختلال ژنتیکی است که در اثر اختلال در عملکرد سلول، برای ترمیم آسیبهای ناشی از پرتو فرابنفش ایجاد میشود. علائم این بیماری، شامل آفتاب سوختگی شدید، تنها پس از چند دقیقه حضور در معرض آفتاب، کک و مک در بخشهای آفتاب خورده، خشکی پوست و تغییر در رنگدانههای پوست است.
اختلال در ترمیم دنا
ترمیم درست DNA از اهمیت فراوانی برای بقای جانداران برخوردار است و خطای این فرایند، موجب ایجاد انواع بیماریها میشود. به عنوان مثال، اکسیداسیون گوانین، توسط رادیکالهای آزاد، منجر به ایجاد جفت باز اشتباهی G-T میشود که یکی از رایجترین جهشها در سرطان است.
سرطان کولورکتال غیرپولیپوز وراثتی، در اثر جهش در پروتئینهای MSH2 و MLH1 ایجاد میشود، که عدم تطابقها را هنگام تکثیر، ترمیم میکند. بیماری زرودرما پیگمنتوزوم (Xeroderma pigmentosum | XP) بیماری دیگری است که در نتیجه عدم موفقیت در ترمیم DNA ایجاد میشود.
بیماران مبتلا به XP، بسیار حساس به نور هستند، پیری زودرس پوست را نشان میدهند و مستعد ابتلا به تومورهای بدخیم پوست هستند. زیرا پروتئینهای XP، که بسیاری از آنها در ترمیم برش نوکلئوتید (NER) دخالت دارند، قادر به ادامه فعالیت نیستند.
1- تعریف جهش :پایداری ماده ی ژنتیکی از نسلی به نسل بعد، به حفظ نرخ جهش در سطوح پایین بستگی دارد. نرخ بالای جهش در لایه ی زایا گونه را از بین خواهد برد و نرخ بالای جهش در سلولهای سوماتیک فرد را از بین خواهد برد. حیات و تنوع زیستی به موازنه ی بین جهش ها و ترمیم آن وابسته است. سلول های زنده به عملکرد صحیح هزاران ژن نیاز دارند که هرکدام از این ژن ها می توانند از طریق جهش در ترادف رمزدهنده پروتئین خود،یا جهش در ترادف های کنترل کننده ی بیان ژن یا پردازش mRNA ،آسیب ببیند.
2- منابع جهش : دو منبع عمده ی جهش، همانندسازی غیر دقیق DNA و آسیب های شیمیایی به ماده ی ژنتیکی هستند.اشتباهات همانندسازی ناشی از توتومریزاسیون است که صحت جفت شدن بازها طی همانندسازی DNA را محدود می کند.همچنین DNA یک مولکول آلی شکننده با پایداری شیمیایی محدود است. DNAنه تنها دچار آسیب های خود به خودی نظیر حذف بازها می شود ،بلکه به وسیله مواد شیمیایی طبیعی و غیرطبیعی و اشعه ها مورد هجوم واقع می شوندکه سبب می شود اسکلت آن بشکند یا بازهای آن از نظر شیمیایی تغییر کنند. سومین عامل مهم در ایجاد جهش مربوط به ورود قطعات DNA به نام ترانسپوزون است.
3- پیامدهای جهش : اشتباهات همانندسازی و آسیب DNA دو پیامد دارد :اول ایجاد تغییرات دائمی در DNA که منجر به تغییر رمز ترادف یک ژن یا ترادف های تنطیم کننده می شود و پیامد دوم آن است که بعضی تغییرات شیمیایی در DNA، سبب عدم استفااده DNA به عنوان الگو در همانندسازی و رونویسی می شود.اثر جهش ها معمولا تنها در نسل هایی از سلول تظاهر پیدا می کنند که تغییر ترادف در آنها صورت پذیرفته باشد.ولی آسیب هایی که مانع از همانندسازی و یا رونویسی می شوند، می توانند اثرات شدیدی در عملکرد وحیات سلول داشته باشند. بدین ترتیب وطایف سلول دو برابر خواهد شد: اول اینکه سلول باید تمامی ژنوم را برای پیدا کردن خطاهای DNA جستجو کند. دوم اینکه سلول باید آسیب وارده را ترمیم کندو عملکرد آن به طریقی باشد که ترادف اصلی DNA حفظ شود.
4- انواع جهش ها : جهش ها شامل هر تغییر قابل تصوری در ترادف DNA هستند.ساده ترین جهش تعویض یک باز با باز دیگر است که به دو حالت مشاهده می شود:
حالت نخست(1) انتقال ساده است که در آن یک باز پیریمیدین باز پیریمیدین دیگر ویا یک باز پورین با باز پورینی دیگر تعویض می شود. نظیر تعویض Tبا C و G با. A حالت دوم (2) انتقال متقاطع است که در آن باز های پیریمیدینی با بازهای پورینی تعویض می شوند. دیگر جهش های ساده (3) شامل ورود ویا حذف تک نوکلئوتیدهاست جهش هایی که باعث تغییر دریک نوکلئوتید می شوند را جهش های نقطه ای می نامند. (4) سایر جهش ها مانند ورود و حذف های گسترده و نیز نوآرایی های بزرگ در ساختار کروموزوم منجر به تغییرات شدیدی در DNA می شود.این تغییرات ممکن است به عنوان مثال توسط ورود یک ترانسپوزون صورت گیرد.بدین ترتیب چندین هزار نوکلئوتید از DNA خارجی به منطقه ی تنظیم کننده یا رمز دهنده ی ژن وارد می شوند.به علاوه این تغییرات می تواند ناشی از عملکردهای نامناسب فرایندهای نوترکیبی باشد.سرعت ایجاد جهش های جدید خود به خودی در هر نقطه ای از کروموزوم حدود6-10 تا 11-10 هر دور از همانندسازی DNA است.بعضی از نقاط کروموزوم “نقاط داغ ” (hot spots ) هستندبه طوری که میزان جهش ها در این نقاط در مقایسه با سایر نقاط بسیار زیاد است. یک نوع از ترادف ها که بسیار مستعد جهش هستند به علت اهمیت آنها در بیماری و ژنتیک انسان مورد توجه قرار گرفته اند.این ترادف های مستعد به جهش ،تکراری از ترادف های دو،سه یا چهار نوکلئوتیدی هستند که به DNA ماهواره ای کوچک معروفند.
(5) از دیگر انواع جهش می توان به تغییرات خود به خودی DNA ناشی از د آمینه شدن و هیدرولیز اشاره کرد. DNA همچنین تحت تاثیر آسیب های خودبخودی ناشی از عملکرد آب نیز قرار می گیرد. (این موضوع تا حدی طنز آمیز است چون ساختار مطلوب DNA دورشته ای وابسته به محیط آبی است.)
شایعترین و مهمترین نوع آسیب ناشی از هیدرولیزمربوط به حذف گروه آمین از باز سیتوزین می باشد در شرایط فزیولوژیک معمولی سیتوزین خود به خود گروه آمین خود را ازدست می دهد وباز غیرطبیعی یوراسیل(وجود یوراسیل در DNA غیرطبیعی است.) را ایجاد می کند. ار آنجا که یوراسیل ترجیحا با آدنین جفت می شود، بنابر اینن در همانندسازی این باز را بجایG که مکمل C است، به رشته ی مخالف عرضه می کند. آدنین و گوانین هردو گروه می توانند آمین خود را به طور خود به خود از دست دهند. آدنین با د آمینه شدن به هیپوگزانتین تبدیل می شود که به جای تیمین با سیتوزین پیوند هیدروژنی می دهد. گوانین با دآمینه شدن به گزانتین تبدیل می شود که در این حالت نیز با سیتوزین (اگرچه با دو پیوند هیدروژنی )جفت می شود . به علاوه ممکن است DNA با هیدرولیز پیوند N- گلیکوزیلی ، پورین خود را از دست بدهد.(دپورینه شدن) بدین ترتیب در DNA جایگاهی بدون باز ایجاد می شود.(یعنی دئوکسی ریبوزی که جایگاه باز خود را از دست داده است.
DNA از طریق آلکیله شدن (6) ، اکسیده شدن (7) و تابش (8) دچار آسیب می شود.
(6) در آلکیله شدن ، گروه های متیل یا اتیل به جایگاه های واکنشگر موجود بر روی باز ها و فسفات های اسکلت DNA منتقل می شود.آلکیله کننده های شیمیایی عبارتند از : نیتروزآمین ها و یک جهش زای بسیار قوی آزمایشگاهی به نام N – متیل N – نیترو- N- نیتروزوگوانیدین. یکی از جایگاه های بسیار آسیب پذیر نسبت به آلکیله شدن ،اکسیژن کربن شماره ی 6 گوانین است .محصول این متیلاسیون ، یعنی O6–متیل گوانین ،معمولا با تیمین جفت می شود که هنگام همانندسازی DNA آسیب دیده موجب تغییر جفت باز C:G به جفت باز A:T می شود.
(7) DNA تحت تاثیر گونه های فعال اکسیژن (نظیر O2–، H2O2، OH) نیز قرار می گیرد.این اکسید کننده های قوی از طریق پرتوهای یونیزه کننده و عوامل شیمیایی ایجاد می شوند ، که تولید کننده ی رادیکال آزاد هستند. به عنوان مثال اکسیده شدن گوانین منجر به ایجاد 7و8 دی هیدرو- 8- اکسو گوانین یا oxoG می شود.اکسو گوانین بسیار جهش زا است چون قادر به تشکیل جفت باز با هردو باز آدنین و سیتوزین است.ا گر با آدنین ایجاد جفت باز کند، در جریان همانندسازی جفت باز C:G به T:A تبدیل می شود.این رایج ترین نوع جهش یافته شده در سرطان های انسانی است.بنابراین شاید قسمتی از اثرات سرطان زایی اشعه های یونیزه کننده و عوامل اکسید کننده مربوط به رادیکال های آزادی باشد که موجب تبدیل گوانین به اکسوگوانین می شود.
(8) اشعه ی ماوراء بنفش از دیگر عواملی است که موجب آسیب دیدگی باز ها می شود. اشعه هایی که دارای طول موج 260 نانومتر هستند به شدت توسط بازها جذب می شوند واین امر موجب اتصال فتوشیمیایی دو باز پیریمیدینی می شود که در رشته ی پلی نوکلئوتیدی در مجاورت یکدیگر قرار دارند. این نوع اتصال را در مورد دو تیمین ، دایمر تیمین می نامند.
این بازهای متصل به هم قادر به ایجاد جفت باز نیستند به همین دلیل موجب توقف DNA پلی مراز در جریان همانندسازی می شود.
به علاوه اشعه گاما و اشعه ی X (تشعشعات یونیزه کننده ) نیز بسیار خطرناکند چون آن ها باعث شکست درهر دو رشته ی DNA می شود، که ترمیم آن ها به سختی صورت می پذیرد.اشعه های یونیزه کننده می توانند مستقیما به دئوکسی ریبوز در اسکلت DNA حمله کنند(باعث یونیزه شدن آن می شوند). این اشعه ها همچنین می توانند به طور غیر مستقیم واز طریق زیرواحد های دئوکسی ریبوز واکنش دهند.
جهش ها به وسیله ی بازهای آنالوگ و عوامل میانگیرشونده (9) نیز روی می دهند.
جهش ها توسط ترکیباتی که جانشین بازهای طبیعی می شوند (بازهای آنالوگ) یا بین بازها قرار می گیرند(عوامل میانگیرشونده)نیز ایجاد شده و موجب بروز خطا در همانندسازی می شوند.آنالوگ های بازها از لحاظ ساختاری مشابه بازهای معمولی هستند ولی از جهاتی متفاوتند. این مساله سبب آسیب به سلول می شود.به بیان دیگر آنالوگ های بازها به اندازه ی کافی با بازهای معمولی مشابه اند تا توسط سلولها گرفته شده ،به نوکلئوزید تری فسفات تبدیل شوند و در جریان همانندسازی در DNA به کار روند.اما به علت تفاوت های ساختاری بین این آنالوگ ها و بازهای معمولی ، آنالوگ ها به طور نادرست در تشکیل جفت باز شرکت می کنند.این امر سبب ایجاد اشتباهات متعددی در جریان همانندسازی می شود.یکی از جهش زا ترین آنالوگ ها 5- برومو یوراسیل است که آنالوگ تیمین می باشد.
5- ترمیم آسیب های وارده به DNA : به طور کلی 3نوع سیستم ترمیمی وجود دارد.در سرراست ترین این سیستم ها آنزیم ترمیم کننده به سادگی آسیب دیدگی را به حالت اول باز می گرداند. یک مرحله تکامل یافته تر، سیستم ها ی ترمیم حذف است که در آن نوکلئوتید آسیب دیده ترمیم نمی شود بلکه از DNA برداشته می شود .در سیستم های ترمیم حذف ، رشته ی دیگر که دچار آسیب دیدگی نشده است به عنوان الگو برای اتصال مجدد نوکلئوتیدهای مناسب توسط DNA پلیمراز عمل می کند.همان طور که خواهیم دید دو نوع ترمیم حذفی وجود دارد در یکی تنها نوکلئوتیدآسیب دیده و در دیگری قسمت کوتاهی از DNA تک رشته ی که حاوی آسیب دیدگی است برداشته می شود. بالاخره مشکل ترین روش ، ترمیم نوترکیبی است.این شیوه وقتی به کار گرفته می شود که هر دو رشته ی DNA دچار آسیب دیدگی شده باشد .نظیر زمانی که DNA می شکند.در نهایت و در آخرین مرحله ی ترمیم زمانی که از پیشرفت همانندسازی DNA به سبب بازهای آسیب دیده ممانعت به عمل بیاید، یک پلیمراز اختصاصی با فعالیت ” گذر از آسیب” جایگاه آسیب دیده را کپی برداری می کند.
a ) بازفعال سازی نوری : بازفعال سازی نوری مثالی از ترمیم به روش به روش برگشت ساده است.واکنش های نوری به طور مستقیم دایمرهای پیریمیدینی حاصل از اشعه ی ماوراء بنفش را به حالت اول بر می گرداند.در بازفعال سازی نوری آنزیم DNA فتولیاز انرژی نور را گرفته و از آن برای شکست پیوندهای کوالانسی بین پیریمیدین های مجاور استفاده می کند.به بیان دیگر بازهای آسیب دیده به طور مستقیم تعمیر می شوند.
B) ترمیم حذف باز : در ترمیم حذف باز آنزیمی به نام گلیکوزیلاز باز آسیب دیده را شناسایی می کند و از طریق هیدرولیز پیوند گلیکوزیدی شناسایی کرده و باز را بر می دارد. قند فاقد باز حاصل در یک مرحله ی دیگر بافعالیت اندونوکلئولیتیکی از اسکلت برداشته می شود.همچنین قندهای فاقد پورین و پیریمیدین که از طریق هیدرولیز خودبخودی ایجاد شده اند، از طریق شکست اندونوکلئولیتیک برداشته می شوند.بعد ازاینکه نوکلئوتید آسیب دیده به طور کامل از اسکلت برداشته شد، یک DNA پلی مراز ترمیمی و DNA لیگاز با استفاده از رشته ی سالم به عنوان الگو، رشته ی آسیب دیده را ترمیم می کند.
(C ترمیم حذف نوکلئوتیدی :آنزیم های ترمیم حذف نوکلئوتیدی ، در هردوطرف محل آسیب دیدگی برش ایجاد می کنند.برخلاف ترمیم حذف بازی ، آنزیم های ترمیم حذف نوکلئوتیدی ، هیچ آسیب دیدگی خاصی را شناسایی نمی کنند. این سیستم از طریق انحرافاتی که در شکل مارپیچ دو رشته ای ایجاد می شود ،عمل می کند. از جمله این انحرافات حضور دایمر تیمین یا وجود گروه های شیمیایی بزرگ بر روی بازهااست.این انحرافات باعث یک سری سلسله رویدادهای پیاپی می شود که طی آن قطعه ی کوچک تک رشته ای دارای آسیب دیدگی حذف می شود..برداشت این قطعه یک شکاف تک رشته ای در DNA ایجاد می کند که توسط DNA پلی مراز پر می گردد. DNA پلی مراز از رشته ای که حاوی آسیب دیدگی نیست به عنوان رشته ی الگو استفاده می کند و بدین ترتیب ترادف اصلی نوکلئوتیدی محفوظ می ماند.
D) شکست دو رشته ای DNA یا (DSB) : کشنده ترین نوع آسیب هایی است که به DNA وارد می شود. در سلولها مسیرهای مشابه متعددی برای کپی برداری از DNA آسیب دیده وجود دارد.بنابراین تعجب آور است که سلولها تنها به سیر ترمیم DSB برای ترمیم این آسیب اتکا نمی کنند.مسیر ترمیم DSB با اتکا براطلاعات موجود بر روی کروموزوم خواهری به ترمیم DNA شکسته شده می پردازد.این یک راهبرد موثر است چون کروموزوم خواهری به عنوان یک الگوی با ارزش برای برگرداندن اطلاعات در ناحیه ی شکسته شده است.
اگر کروموزومی که هنوز همانندسازی نکرده است دچار شکست شود چه اتفاقی رخ خواهد داد؟
در چنین شرایطی هیچ کروموزوم خواهری وجود نخواهد داشت تا به عنوان رشته ی الگو در ترمیم DSB مورد استفاده قرار گیرد.بنابراین سیستم دیگری به نام سیستم اتصال دهنده ی انتهای غیر همولوگ یا NHEJ ایفای نقش می کند. NHEJ در مخمر نقش سیستم کمکی را دارد ولی در موجودات عالی تر نقش اساسی در ترمیم شکستگی ها ایفا می کند.مراحل فرایند NHEJ نظیر ماشینی است که در حفاظت انتهای شکسته شده و سپس اتصال آنها به یکدیگر نقش دارد.چون در جریان NHEJ ، ترادف اصلی در اطراف محل شکست به درستی بازگردانیده نمی شود.بنابراین در انتهای شکسته شده اطلاعات ترادف ها از بین می رود.مسیر NHEJ یک مسیر جهش زا می باشد.بااین حال جهش هایی که از طریق مسیر NHEJ ایجاد می شوند ، نسبت به وقتی که انتهای شکسته شده بدون ترمیم رها گذاشته شوند،برای سلول خطر کمتری دارد.
NHEJ با استفاده از چه مکانیسمی انتهای DNA را به هم متصل می کند؟ NHEJ همانطور که از نامش هم پیداست در طویل سازی ترادف های همولوگ نقشی ندارد بلکه دو انتهای تک رشته ای DNA شکسته شده را از طریق اتصال ناهمگون به یکدیگر متصل می سازد. به نظر می رسد که این نوع همردیفی ، با جفت شدن بین قطعات کوچکی (حتی به کوچکی یک جفت باز) از باز های مکمل صورت می پذیرد.دم های تک رشته ای توسط نوکلئازها برداشته شده و شکاف ها توسط DNA پلیمراز پر می شود.
فرایند سنتز “گذر از آسیب ” باعث عبور همانندسازی از روی منطقه آسیب دیده DNA می شود.
در مثال های ذکر شده این گونه در نظر گرفته می شد که آسیب های وارده به DNA از طریق حذف و پس از آن ساخت دوباره ی DNA با استفاده از رشته ی آسیب ندیده به عنوان الگو، ترمیم میشود.ولی چنین سیستم های ترمیمی به طور کامل کارآمد نیستند و بعضی اوقات DNA پلیمراز با آسیب هایی نظیر دایمر پیریمیدینی یا جایگاه های بدون پورین مواجه می شود که ترمیم نشده اند.چون چنین آسیب هایی موانعی در پیشرفت DNA پلیمراز ایجاد می کنند، بنابراین ماشین همانندسازی باید سعی کند یا منطقه آسیب دیده را کپی برداری کند یا همانندسازی را متوقف کند.حتی اگر سلول قادر به ترمیم این آسیب ها نباشد، مکانیسم fail-safe باعث می شود تا ماشین همانندسازی از این جایگاه ها عبور کند.این مکانیسم به سنتز گذر ازآسیب معروف است.هرچند که این مکانیسم بسیارمستعد خطاست و در نتیجه منجر به ایجاد جهش می شود ولی سلول را در برابر همانندسازی ناقص کروموزوم حفاظت می کند.
خلاصه ای از فصل 9 ، زنتیک مولکولی واتسون .2008
تهیه توسط م. قربانی
